Химический состав и строение воды
Молекула воды состоит из двух атомов водорода и одного атома кислорода. Атомы водорода имеют 3 изотопные формы, а кислорода – 6, таким образом, теоретически могут быть 36 разновидностей молекул воды, из которых в природе встречают 9.
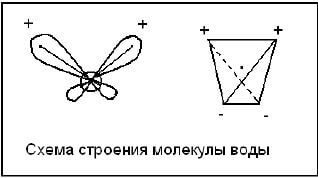
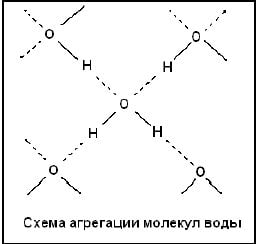
Ядра водорода и кислорода образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине – ядро атома кислорода. Из 8 электронов внешнего электронного слоя кислорода две пары образуют ковалентные связи О-Н, а остальные – две неподеленные электронные пары. Электроны, образующие связи О-Н, смещены к электроотрицательному кислороду, в результате чего атомы водорода приобретают эффективные положительные заряды. Неподеленные электронные пары смещены относительно атома кислорода и создают два отрицательных полюса. Таким расположением зарядов определяется дипольный характер молекул воды, поэтому электролиты в воде легко диссациируют на ионы в результате притягивания дипольными молекулами воды. В замерзшей воде атом кислорода участвует в образовании двух водородных связей с двумя соседними молекулами. Молекулы воды, соприкасающиеся друг с другом разноименными полюсами, образуют слои. Каждая молекула связана с тремя другими из того же слоя и с одной – из другого слоя. При такой структуре образуются пустоты размером больше молекул воды. Вследствие этого плотность льда меньше 1.
При таянии льда часть водородных связей разрушается, оторвавшиеся молекулы занимают пустоты, в результате чего плотность воды возрастает. С нагреванием температуры воды выше 4оС разрыв водородных связей продолжается, уплотнение воды преобладает над эффектом теплового расширения.
После прогревания воды выше 4оС начинает преобладать тепловое расширение над уплотнением, вызываемым продолжающимися разрывами водородных связей. Разрыв всех связей происходит только при переходе воды в пар. Эта особенность – аномальное свойство уменьшать плотность с понижением температуры воды от 4оС до 0оС (для пресной воды) – во многом отличает воду как среду обитания. При замерзании вода расширяется и превращается в лед, который легче воды, плавает на ее поверхности и образует теплоизоляционный слой. Из-за этого водоем не промерзает полностью до дна. Более того, холодные слои воды не погружаются вглубь, они плавают на более теплых.
Летом прогретые слои воды не опускаются ко дну, где находятся более холодные и поэтому более плотные слои. В результате, в воде образуется слоистость или температурная стратификация, которая предупреждает прогревание водоема до дна.
Даже в сравнительно неглубоких водоемах вода не то, что не промерзает зимой, но и не опускается ниже 4оС, а летом - не прогревается полностью. Например, в рыбоводных прудах глубиной 1,5 – 3 м разница температур у дна и на поверхности в жаркие летние дни может достигать 7-10оС (конечно, если слои не перемешиваются ветром или специальной техникой).
