ПЕРИОДИЧЕСКОЕ КУЛЬТИВИРОВАНИЕ СВОБОДНОЖИВУЩИХ ПРОСТЕЙШИХ
Со времени открытия простейших, т. е. с 1675 г., осуществляется их периодическое культивирование (индивидуальное и массовое) с целью подробного изучения в лабораторных условиях в течение круглого года.
Индивидуальное культивирование свободноживущих простейших. Отдельная клетка помещается в микроаквариум со средой и кормом. Затем через определенные промежутки времени (например через сутки) учитывается количество особей, одна особь снова помещается в свежую среду с кормом и т. д.
Данный метод впервые применени E. Мопа (Maupas, 1888 1 для определения темпа деления инфузорий в зависимости от условий кормления и температуры. В опытах использовались стекла с каплей среды, помещенные во влажную камеру. В более поздних исследованиях (Лозина-Лозинский, 1929; Цингер, 1947; и др. 1 Д.Тя этих целей применили часовые стекла, помещенные во влажную камеру.
Для стерильного содержания индивидуалкой культуры ис - пользуются либо пластины слунками, покрытые стеклом, для предотвращения испарения [Полянский, 1957; Ковалева, 1963; ?окова, Лисовский, 1968; и др. , либо стеклянные кольца, помещенные в расплавленный питательный агар до автокатаврования [Curds, Vandyke, 1966).
Время удвоения простейших в индивидуальной культура К. Кэрдс с соавторами (Curds, Vandyke, 1966] определяли по уравнению
R log B — log A / log 2
где А и В — число инфузорий в первый и второй день соответственно,
в индивидуальной культуре подобрана и исследована синтетическая среда для да рамеций (Лозина-Лозинский, 1929). Среда озина-Лозинского использовалась многими протозоолоТа ми |Полянский, 1957; Ковалева, 1963; и др.] для различных
опытов. в следующем составе она широко применяется ив настоящем (в%): NaCI — 0,01; КСІ — 0,001; CaCl, — 0,001;
MgCl, — 0,001; NaHCO, — 0,002.
в качестве корма для инфузорий берется смесь дрожжей Saccharorn yces allipsoides и бактерий Bacillus subtilis в соотношении 1:1 по объему сырой массы [Ковалева, 1963) или различные бактерии [Curds, Vand yke, 1966).
Изучая влияние тепловых шоков и холода на синхронизацию деления Paramecium aurelia в зависимости от возраста клеток, Г. Уитсон (Whitson, 1964] использовал индивидуальную культуру. Инфузорий содержали в солонках на отваре салата. Автор отмечает, что под действием тепловых шоков коебания в делении больше при 37,5°С, чем при 36°C. Свозрастом клетки они возрастают. Клетки, подверенные влиянию высокой температуры в начале деления, имели необратимые повреж;дения, что вызывало появление громадных «чудовищ).
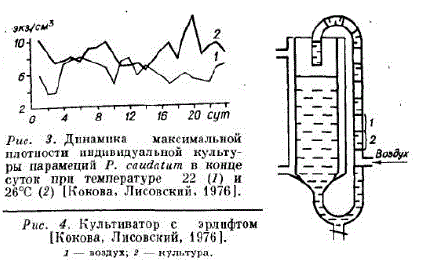
Для изучения влияния различного корма и температуры на рост Paramecium caudatum нами использованы микроаква риумы, или солонки, 2 см, с объемом рабочей среды 0,3-0,5 см. Парамеций содержали на среде Лозина-Лозинского, в качестве корма служили хлорелла, дрожжи, бактерии (Кокова, Тисовский, 1976). На рис. 3 показана плотность культуры Paramecium caudatum, при кормлении смесью дрожжей Saccharomyces ellipsoides и бактерий Bacillus subtilis. Удельную скорость роста определялії по уравнению
In N p = .
Где N — среднее число организмов, полученных за сутки от исходной особи в результате размносения; t — время культивирования, равное 24 ч. При 22°С и культуры составила 0,0670 ч-1, апр 26 °C — 0,0866 ч., что совпадает с литературными данными [Darby, 1929; Curds, Vandyke, 1966 ].
Массовое периодическое культивирование свободноживущих простейших позволяет исследователям получать большое количество материала и осуществляется аксенно, моноксенно и т. д.
Обычно в сосуд помещается органическое вещество (сено, на Воз, гидролизные дрожаби, а также почва, банановые корки и др.), добавляется вода, где и развиваются бактерии, слуiaщие кормом для простейших, например инфузорий.
Наиболее широко для массового периодического метода используется сенной отвар. Берут 10 г сена и помещают в 1 л воды, кипятят в течение 20 мин, затем фильтруют и разбавляют равным количеством воды [Mayer, 1956) или используют без разбавления (Цингер, 1947; Иванов и др., 1958; Sonneborn, 1970).
Культивирование простейших и других водных беспозвоночных на отварах ведется либо нестерильно (на отва ре развиваются различные бактерии, попавшие из воздуха) или моноксенно (в стерильный отвар Высевается один вид бактерий).
ІШироко применяется также аксенный метод [Everhart, 1972; Finley, 1966 ] для различных цитологических, физиологических и других исследований. При этом питание осуществляется путем пиноцитоза (Rosenbaum е. а., 1962; Hall, 1968) и т. д. Используя сенной настой, многие авторы [Balbiani, 1898; Кулагин, 1900; Calkins, 1902; Jones, 1932; Proper, Garver, 1966) получали долгоживущую культуру различных инфузорий, Максимальная биомасса в культуре Сol poda Steinii составила 12,5 г/л сухого вещества [Proper е. а., 1966 ].
Нами в периодической массовой культуре исследовано влияние концентрации корма на рост различных видов парамеций. Популяцию содержали в реакто ре объемом 0,2 л (рис. 4), который можно использовать в различных модификациях: с пластиннами для увеличения площади оседания на рамеций и без них для получения гомогенной культуры, с двумя эрлифтами с целью улучшения аэрации (см. рис. 12). В данном случае опыты проводили с двумя эрлифтами и пластинами внутри.
Культуры Paramecium caudatum и P. aurelia получены в Биологическом институте г. Петергофа. Пара меций содержали нестерильно на среде Лозина-Лозинского, кормом служили дрожжи и бактерии в соотношении 10: 1. Концентрацию корма корректировал и через 2 чв течение опыта по уравнению
(S – Sk) и
(9)
vс -
где Е. — объем исходной суспензии дрожжей, который необходимо внести при коррекции, см3; 8 — заданный уровень концентрации дрожжевого корма, млн. кл./см; se — фактическая концентрация корма перед коррекцией, млн. кл./ см; S, — концентрация исходной суспензии дрожжей, используемой для коррекции, млрд. кл./см; у объем культуры, см3.
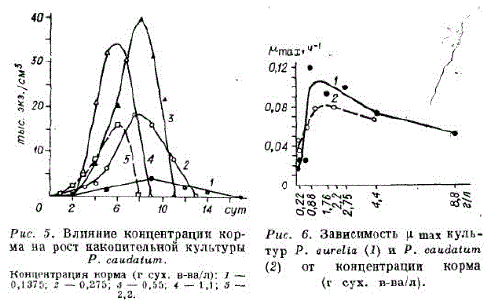
Исследованы следующие концентрации корма для Paraтесim caudatum (г сух. в-ва/л): 0,1375; 0,275; 0,55; 1,1 и 2.2.
Один или два раза в сутки культуру Перемешивали с помощью стеклянной трубки, по которой подавался воздух, и брал 1 мл суспензіни для определения ее плотности.
Исходная плотность — 0,1 тыс. экз./см, динамика плотности показана на рис. 5. Наиболее устойчивый процесс получен при концентрации корма 0,275—0,55 г/л, дальнейшее ее Новышение привело к снижению устойчивости и Kmax культуры (рис. 6).
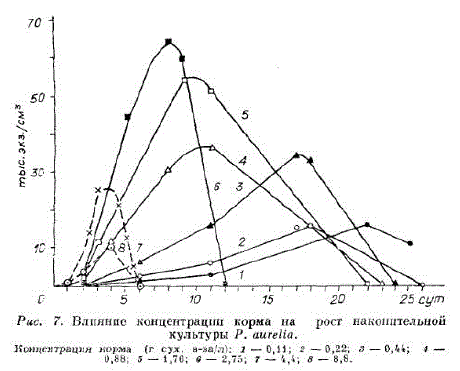
Paramegirm aurelia содер?али также в реакторе объемом 0,2 л (см. рис. 12). Концентрация корма (г сух, в-ва/л): 0,11; 0,22; 0,44; 0,88; 1,76; 2,75; 4,4 и 8,8. Исходная плотность - 0,1 тыс. экз./см*. Наиболее устойчивая периодическая культура P. aurelia с высокой максимальной плотностью наблюдалась при концентрации корма 0,88—1,76 г/л (рис. 7), хотя и при более высоких концентрациях и max оставалась высокой, но процесс был неустойчивым, популяция быстро погибала.
При периодическом процессе гибель культуры многие исследователи связывали с изменением физико-химических условий среды [Darby, 1929; 1930; Robertson, 1927; Prescott, 1957; Grebecki, 1961а) и недостатком корма [Chejfec, 1929]. В наших опытах, несмотря на постоянную коррекцию концентрации Корма, инфузории гибли. Мы связываем их гибель с изменение химических условий среды, главным образом с увеличением концентрации продуктов метаболизма.
Следует отметить, что Paramecium airrelia (см. рис. 7) способна выносить более высокие концентрации корма, чем P. caudatum.
В литературе имеются сведения, когда исследователи пытались произвести обмен среды путем добавления свежей среды и удаления отработанной через фильтр, с целью поддержания плотной культуры парамеций (Статкевич, 1903; Grebecki, 1961); Корниенко, 1970). А. Гребецки получил плотность популяции Paraecium caudatum около 7300 экз./см3, но ее рост при этом прекратился вследствие обрастания фильтра, хотя автор производил обмен среды через фильтр до 10 об./сут, Это позволяет сделать вывод о том, что устойчиво и долго плотная культура простейших может расти в реакторе, где будут созданы оптимальные условия по pH, кислороду, корму, температуре и обмену среды, возможно, без фильтра. Оптимальные условия для Paramecium caudatum: pH среды -- 6,8 [Morea, 1927; Darby, 1930; Loefer, 1936; Gaw, 1936; Wichterman, 1948, 1953 ]; температура — 26°C [Суханова, 1968); корм — дрожжи -- бактерии (Полянский, 1957), концентрация бактерий и дрожжей в соотношении 1:10 — 0,3-0,5 г/л.