КУЛЬТИВИРОВАНИЕ ПРОСТЕЙШИХ ИЗ РУБЦА ЖВАЧНЫХ ЖИВОТНЫХ
Большой вклад в изучение простейших рубца и разработку методов культивирования сделан отечественными Догель, 1927, 1951; Полянский и Стрелков, 1935] и зарубежными учеными (Cleveland, 1923, 1925; Coleman, 1958, 1960а, б, 1962, 1972, 1975, 1978; Hungate, 1966; Tompkin е. а., 1966; Курихара, 1970: Онодора, Кандацу, 1970; Coleman е. а., 1972, 1974; Slyter е, а., 1975; и др.].
Как отмечает Я. Курихара (1970), во-первых, простейшие рубда обладают целлюлазой, амилазой и другими ферментами и расцеляют в рубце жвачных животных целлюлозу, крахмал и другие углеводы с образованием летучих жирных кислот (углекислый газ, метан, аммиак и др.), которые усваиваются животными; во-вторых, они аккумулируют в своем организме в форме полисахаридов большое количество углеводов, предупреждают их быструю атаку бактериями и одновременно игра - ют роль резервного депо углеводов в кор ме и состоянии голодания; в-третьих, их тела, содержащие 10— 40% общего азота рубца [Hungate, 1966], — важный источник белка для асивотных. Белок простейших по питательной ценности для хозяев превосходит белки корма и бактерий (ягнята с простейшими росли быстрее, чем без них) (Jonson е. а., 1944; Abоu Akkаdа е. а., 1964]. Сравнение их аминокислотного состава с таковым луговых трав и бактерий Свидетельствует о высоких величинах таких аминокислот, как изолейцин, лейцин, фенилаланин, дизин и др.
В настоящее время методы культивирования простейших из рубца разработаны достаточно хорошо.
Культивирование in vivo и in vitro простейших из рубца. с целью культивирования простейших рубца in vivo заражают только что родившихся акивотных (например, ягнят), а затем берут пробы с помощью шланга Полянский, Стрелков, 1935] или через фистулу [Michalowski, 1977). Однако такой метод отбора проб довольно трудоемкий. Если животное зараЖено определенным видом простейших, то необходимо следить, чтобы оно не вступало в контакт с другими животными, так как может произойти заражение другими формами. Помимо этого, необходимо четко соблюдать рацион кормления и учитывать физиологические возможности животного [Mowry е. а., 1930; Welch е. а., 1975].
Сравнительная оценка роста простейших и бактерий в рубце бычка (in vivo) ив ферменте для непрерывного культивирования (in vitro) проведена Л. Слайтером с соавторами (Slyter е. а., 1967 ] в течение 14 сут. Из простейших в непрерывной культуре обнаружены Entolinium и Diplodlinium во время отбора проб на 3-, 7- и 14-е сутки. Holotrichа исчезали in vitro после з сут культивирования.
Авторами не замечено разницы в целлюлозолитической и аминолитической деятельности, а также в продуцировании кислот из глюкозы между микробами в рубце и ферментере. Число простейших было нике, а число бактерий выше в ферментере, чем в рубце. В рубце ив ферментере установлены аналогичные изменения в числе определенных бактерий.
в последние четыре десятилетия в литературе появилось много данных по изучению простейших из рубца in vitro, впepвые работы были связаны с применением сред, содержащих желудочный сок (Coleman, 1958; Tompkin е. а., 1966). Г. Колеман (Coleman, 1958, 1960] утверждал, что инфузорий Entodi, піит моято выращивать in vitro неограниченно долгое время, Однако, отмечает автор, в связи с недостаточно отработанной методикой Длительность Таг-фазы Інногда затягивается до 2—8 нед.
Влияние различной концентрации якидкости рубца на рост простейших изучали Р. Томикин с соавторами (Tompkin е. а., 1965]. Они отметили, что желудочный сок с хлопьями отрица - тельно влияет на Entolinium in vitro, поэтому его необходимо центрифугиро1зать. Желудочный сок от беременных овец более сильно стимулирует рост простейших рубца.
Следующий этап Культивирования простейших рубца - создание искусственных сред, правда, на первых порах их разработки использовались добавки желудочного сока [Coleman, 1960б, 1972).
Разработав метод выращивания простейших рубца in vitro, исследователи использовали его для изучения простейших. Б. Ярвис с соавторами Yarvis е. а., 1968 при кормлении Entodinium simplex различными травами и зерном пшеницы обнаружили, что состав популяции бактерий сильно влияет на рост E. simplex.
Г. Колеман (Coleman, 1975] показал, что инфузории и бактерии рубца жвачных взаимно полезны. Entodirnium spp. заглатывают крахмал и белковый материал и делают сахара и аминокислоты доступными для бактерий, находящихся в среде и цитоплазме. Бактерии, растущие в этих условиях, поддерживают низкий окислительно-Восстановительный потенциал, необходимый для роста инфузорий. Простейшие питаются бактериями, заглатывая до 1% от содержимого в рубце.
Для изучения питания простейших используют стерильные культуры, полученные с помощью пенициллина (Coleman, 1960б, 1972). В такой культуре Г. Колеману удалось выяснить, что E. simplex, как и E. caudatum, использует углеводы в качестве источника энергии, а предлагаемые определенные виды бактерий — в качестве источника аминокислот для синтеза белков.
Аппараты для непрерывного культивирования простейших рубца разработаны сравнительно давно |Adler е. а., 1958; Rufener е. а., 1963), затем они в различной модификации применялись для изучения и выращивания простейших in vitro. В. Руфенер с соавторами [Rufener е. а., 1963 ] для поддержания культуры простейших рубца в непрерывном рећи ме использовали смесь искусственной слюны (60 частей) и воды (40 частей), а также различный корм (пшеничные отруби, мука соевых бобов, костяная мука) и добавки известняка. Скорость протока среды — 1,43 об./сут.
Л. Слайтер с соавторами (Slyter е. а., 1975) непрерывно культивировали микробы рубца in vitro при скорости протока 1,6 об./сут, Гранулированный корм (древесная масса — 83,5%, минеральные соли — 5,5 %, соевое масло — 10,9 %) подавался автоматически через 37 мин. Мочевина вливалась в различной пропорции (3,4—6,5 %) к поданному протеину. Добавлялись свободные аминокислоты. Авторы изучали оптимальные условия синтеза микробов рубца в непрерывной культуре in vitro.
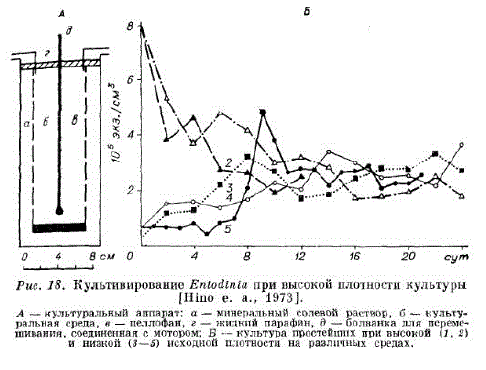
Т. Хино с соавторами Hino е. а., 1973) разработали несколько синтетических сред, которые с различными добавками корма (яйцо, рисовый крахмал, порошок целлюлозы и белого Клевера), а также пенициллина обеспечили рост Entodinium в течение 10 мес. Ими разработан специальный аппарат (рис. 18, а) для выращивания культуры с высокой плотностью, а также для исследований влияния доли инокулята и различных сред (рис. 18, в) на ее плотность. Для успешного выращивания простейших из рубца требуется оптимальная температура 38— 39°С, поддержание анаэробных условий, например, с помощью азота [Adler е. а., 19581 или смеси азота (95 %) и углекислого газа (59%) [Coleman, 1972); рН поддеркивается (около 6—7) с помощью добавок искусственной слюны [Rufener е. а., 1963) или с помощью фосфатного буфера [Hino е. а., 1973).
С целью изучения скорости деления получена клональная культура Entodinium caudatum, которая выращивалась in vitro в течение 14 нед (Hino е. а., 1973]. Культивирование in vitro простейших из рубца способствует развитию цитологических исследований [Stern е. а., 1977].
Таким образом, от литературного обзора видно, что в настоящее время разработаны методы культивирования простейших из рубца in vivo и in vitro.
Периодическое культивирование in vitro простейших из рубца 1. Взадачу наших исследований входило освоить методы выращивания in vitro простейших из рубца, а также определить скорость переработки ими соломы.
Периодическое культивирование простейших из рубца осуществляли в колбах объемом 350 см. Колбы закрывали резиновыми пробками. В каждую колбу помещали по 30—50 см3 жидкости рубца, взятой у только что убитого животного (коровы, быка), затем доливали среду с кормом до пробки.
Во всех опытах нами использована синтетическая среда, разработанная Р. Онодора и М. Кандацу (1970). К1 л дистиллированной воды добавляли (г): NaCl – 2,6; KCl — 0,2; CaCl, — 0,1; MgSO4 — 0,1; КНРО, — 9,0; Na,НРО, – 15,0. Соли растворяются в указанном порядке.
Кормом слузкила пшеничная солома. После добавятения корма и среды содержимое колбы газировали углекислым газом 3 мин, пробку заливали парафином и помещали в термостат с температурой 38°C. Один раз в сутки стивали 0,5 объема культуры идоливали свежую среду с кормом.
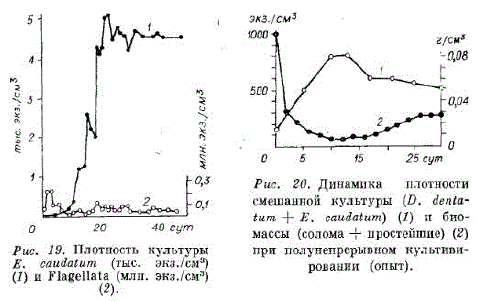
В опыте 1 в качестве корма использовали пшеничную солому с концентрацией 1,5 г/100 мл среды. В первые сутки в культуре преобладали мелкие формы простейших Flagellata. На 20-е сутки опыта плотность Flagellata снизилась, а Entodiпium caudatum достигла 4,5 тыс. экз./см2 и удерживалась до конца 47-суточного опыта (рис. 10).
Таким образом, простейшие из рубца с сопутствующей флорой могут довольно долго расти в периодической культуре при кормлении их соломой.
Для установления скорости переработки биомассы соломы проведен опыт 2. В отличие от опыта 1 биомассу из сливаемой массы суспензии центрифугировали и возвращали в колбу, Добавляя при этом свежую средус кормом. В контроле биомассу из сливаемой части суспензии не возвращали. Один раз в 4—5 сут определяли сухой вес биомассы в культуре. Для этого 50 мл сливаемой части суспензии высушивали, полученный сухой осадок взвешивали.
Исходная плотность смешанной культуры E. caudatum и Diplodinium dеntаtет составила 1 тыс. экз./см3. В культуре присутствовало небольшое количество простейших Flagellata и
флора рубца. Опыты продолжались 30 сут (рис. 20, 21).
В первые сутки возвращаемая биомасса из сливаемой суспензии и добавки свежего корма повысили биомассу в культуре до максимально возможной, т. е. переработки не наблюдалось. Это, вероятно, связано с тем, что возвращаемый в колбу осадок успевал охлаждаться в центрифуге и тем самым ухудшал условия для роста простейших. С повышением плотности культуры простейших процесс переработки улучшался. В среднем скорость переработки соломы составила 3 г/(л• сут), что в 3,3 раза ниже, чем микробным ценозом, состоящим из актиномицетов, дрожжей, плесневых грибов в аэробных условиях [Посадская и др., 1976].
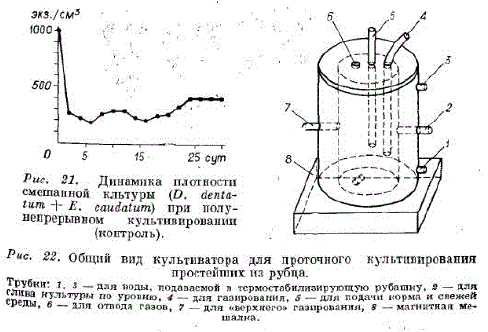
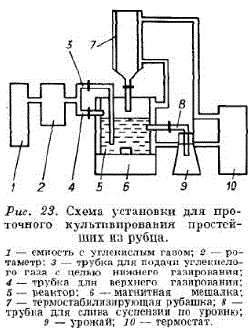
Непрерывное культивирование in vitro простейших из рубца. Нами был изготовтлен культиватор из оргстекла объемом 2500 см3 цилиндрической формы (рис. 22). Принцип его работы аналогичен разработанному л. Слайтером [Slyter е. а., 1964. Температура культивирования 39°С. Для обеспечения анаэробных условий проводили верхнее и нижнее газирование углекислым газом. При верхнем газировании газ подавался по трубке 4 через 1,5-2 ч, при нижнем — через трубку з после долива свежей среды с кормом. Газирование во всех случаях продолжалось 3 мин. Культуру содержали на среде Р. Онодэра и М. Кандацу (1970) при скорости протока 1,6 об./сут. В качестве корма использовали пшеничную солому (2 г/л) и муку (2 г/л). Кормовую смесь помещали в сингтетическую среду и содержали в термостате (не более 1 сут.)
Свежую среду доливали с кормом 4 раза в сутки по 0,4 объёма. Сразу же после долива начиналось нижнее газирование CO., затем в течение 10 мин культуру перемешивали и сливали по уровню. Скорость разбавления 0,067 ч.
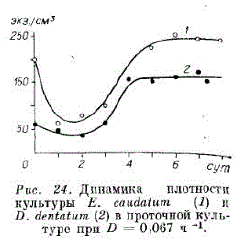
В первые сутки плотность популяции снижается, а затем удерживается для E. caudatum более 200 экз./см3, а D. dentatum — около 150 экз./см3 (рис. 24).
Таким образом, непрерывное выращивание простейших из рубца возмокно на синтетических средах с использованием вкачестве корма соломы и муки.
Методы проточного культивирования открывают широкие перспективы дальнейшего исследования простейших из рубца in vitro и их роли в естественных и искусственных ценозах, включающих человека,
Полученная нами скорость переработки соломы в 3 раза ниже, чем в аэробных условиях с помощью различных грибов (Посадская и др., 1976), однако, учитывая более благоприятную для животных по биохимическому составу биомассу простейших рубца, исследования в этом направлении, вероятно, следует Продолжить.