Снижение реакционной способности фосфора
Фосфор в природных водах представлен тремя основными группами: растворимый реакционноспособный фосфор (преимущественно минеральный), растворимый нереакционноспособный – органический фосфор и фосфор в частицах (отделяется от двух других при помощи фильтрования) (Rigler, 1973). Сумма первой и второй группы называется также растворимым фосфором, а сумма всех трех групп – общим фосфором.
Особый интерес вызывает растворимый реакционноспособный фосфор, именно он в первую очередь участвует в биологических реакциях. Эта фракция фосфора в основном состоит из ортофосфатов (PO43–), которые непосредственно используются для процессов фотосинтеза и могут существенно лимитировать рост водорослей, находясь в недостатке. Несмотря на то, что концентрация фосфатов, особенно в вегетационный сезон, обычно низкая, существенного их недостатка для растений не наблюдается. Происходит это из-за высокой скорости обменных реакций с участием фосфора. Например, в летний период полный цикл этого элемента может пройти всего за минуту.
Снижая концентрацию фосфора до предела, лимитирующего рост водорослей, можно предотвратить нежелательное «цветение» воды. В случае
значительного сокращения внешней нагрузки и при низких скоростях поступления из донных отложений, количество фосфора может быть снижено и как следствие может наблюдаться быстрое оздоровление водоема. Однако подобная ситуация является скорее исключением, чем правилом (Cooke, 2005). Другие источники фосфора, в основном внутренние, восполняют его недостаток в воде и требуют проведение дополнительных мероприятий.
Доступность фосфора можно уменьшить, повышая интенсивность его седиментации (инактивация фосфора) или сокращая поступление фосфора из донных отложений, при помощи таких методов как аэрация, оксигенация, внесение нитратов и изолирование.
Инактивация фосфора, его цель – удаление доступного фосфора из водной толщи и замедление обменных реакций между донными отложениями и придонными слоями воды. Связывание свободного фосфора осуществляется внесением химических добавок с его последующим осаждением. Добавки вносят непосредственно в воду с плавсредств, распыляют с самолетов или же рассыпают по льду (рис. 2.1.4). Наиболее широкое применение нашли в основном соединения алюминия и железа, в меньшей степени кальция (Klapper, 2003). По способности удерживать фосфор, связывающие вещества расположены в следующей убывающей последовательности: Al>Fe>Ca. Стоимость реализации подобных мероприятий составляет порядка 300 тыс. руб. на гектар акватории.
Алюминий вносят в виде сульфата или хлорида алюминия (Al2(SO4)3, AlCl3), алюмината натрия (Na2Al2O4) в дозировках от 3 до 30 г/м3 в пересчете на Al (Hupfer, Hilt, 2008). Некоторые авторы предлагают использовать для определения дозы молярные соотношения межу концентраций алюминия и фосфора в воде и донных отложениях, например, 4:1. Железо вносят в виде сульфата (FeSO4), хлорида (FeCl2 и FeCl3) или хлоросульфата железа (FeClSO4) в количестве от 1 до 150 г/м3 в пересчете на Fe. Внесение железа часто сочетают с мероприятиями, улучшающими кислородный режим в водоеме: дестратификацией, аэрацией гиполимниона, добавлением нитратов. Иногда для
осаждения фосфора применяют карбонат или гидроксид кальция от 10 до 250 г/м3 в пересчете на Ca. Необходимо учитывать, что внесение гидроксида кальция может привести к гибели макрофитов и других гидробионтов, вследствие кратковременного, но резкого повышения величины pH.
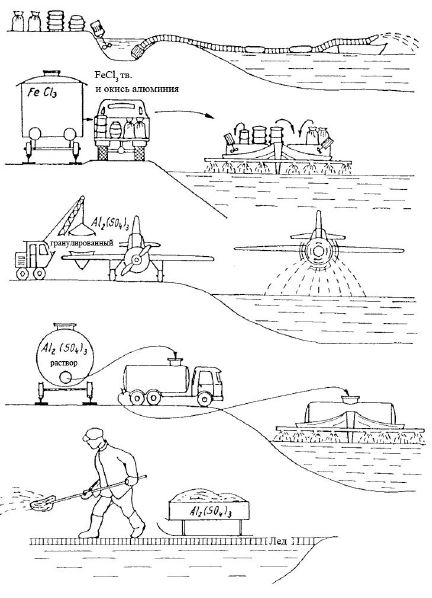
Рис. 2.1.4. Способы внесения реагентных добавок (Klapper, 2003)
В мелководных озерах с высокими значениями pH в течение лета, также может наблюдаться высвобождение фосфора из связанных с железом и алюминием форм, вследствие обменных реакций с гидроксид-анионом. Можно
отметить, что эффективность внесения фосфор-связывающих добавок оказывается особенно высокой, если озеро имеет низкую интенсивность водообмена (Hupfer, Hilt, 2008).
Для лучшего понимания процессов инактивации фосфора, можно рассмотреть химические реакции, происходящие при поступлении связывающих добавок.
При внесении солей алюминия, происходит их быстрая диссоциация с образованием ионов Al3+, которые тут же гидратируются:
Al3+ + 6H2O - Al(H2O)63+
Далее, через серию реакций гидролиза, образуется гидроксид алюминия Al(OH)3 – в виде аморфных коллоидных хлопьев с высокой адсорбционной способностью к фосфору:
Al(H2O)63+ + H2O - Al(H2O)5OH2+ + H3O+
Al(H2O)5OH2+ + H2O - Al(H2O)4OH+ + H3O+
и т.д.
Опуская молекулы воды, получаем:
Al3++ H2O - Al(OH)2+ + H+
Al(OH)2+ + H2O - Al(OH)2+ + H+
Al(OH)2+ + H2O > Al(OH)3?+ H+
Гидроксид алюминия образует раствор молочного цвета, из которого быстро начинают выделяться крупные частицы. Они быстро растут в размере и по массе, образуя видимые хлопья, которые проходят через водную толщу и осаждаются на дно. Этот процесс происходит довольно быстро, поэтому прозрачность восстанавливается в течение нескольких часов.
Кислотно-основные свойства воды определяют химическую форму продуктов гидролиза алюминия и их растворимость (рис. 2.1.5). При значениях pH воды, характерных для большинства пресноводных озер (6-8), доминирующей формой являются нерастворимые полимеризованные образования гидроксида алюминия (Al(OH)3), обладающие наилучшей способностью к захвату и удерживанию соединений фосфора (лучше всего неорганических). При pH от 4 до 6 образуются разнообразные растворимые формы, а при pH ниже четырех, преобладающей формой становится алюминий в ионной форме (Al3+). Последняя форма очень опасна, т.к. является остротоксичной для гидробионтов, в особенности для рыб.
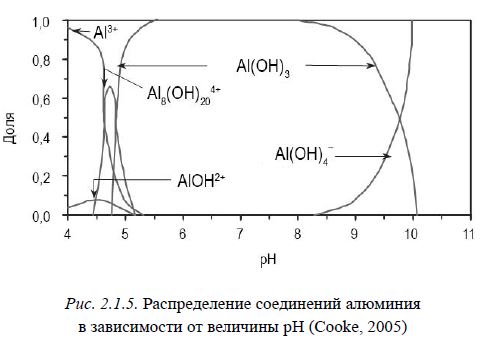
Рис. 2.1.5. Распределение соединений алюминия
в зависимости от величины pH (Cooke, 2005)
Необходимо учитывать, что в ходе растворения солей алюминия происходит образование водородных ионов, которые, при низкой буферной емкости водоема, могут привести к понижению pH и как следствие преобладанию хорошо растворимых форм алюминия и высвобождению фосфора. В водоемах с низкой и средней щелочностью (<30 и 30-50 мгCaCO3/л) очистка с помощью солей алюминия может вызвать существенное снижение pH, даже при низкой их концентрации (рис. 2.1.6). При этом параллельно
возрастает доля токсичных форм, таких как Al+и Al(OH)2+ (Cooke, 2005). В этих случаях процедуру необходимо проводить с особой осторожностью. При таком выполнении можно обойтись без существенного изменения pH, при значительном снижении концентрации растворенного фосфора.
Для устранения этой проблемы также можно использовать сопутствующее внесение веществ, повышающих щелочность водоема, например: гидроксида натрия, кальция или карбоната натрия. Хорошим решением может стать использование алюмината натрия (Na2Al2O4) – вещества обеспечивающего буферную емкость, при большом содержании алюминия. Возможно использование готовых коммерческих препаратов, уже содержащих в своем составе буфер, например, PHOSCLEAR™ (смесь сульфата алюминия 60-85% и кальцинированной соды 15-40%).
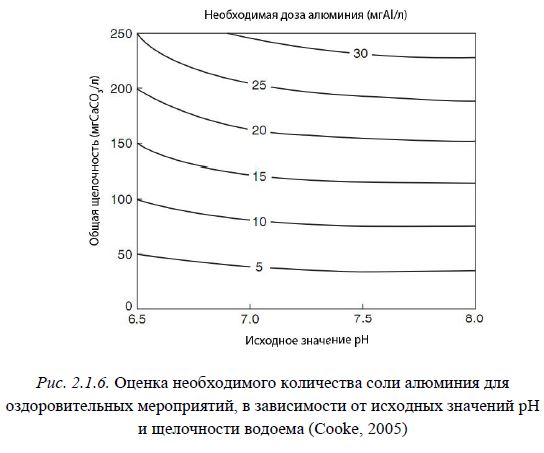
Рис. 2.1.6. Оценка необходимого количества соли алюминия для оздоровительных мероприятий, в зависимости от исходных значений pH и щелочности водоема (Cooke, 2005)
При высоких значениях pH (более 8), например, в случае интенсивного фотосинтеза, образуется амфотерный алюминат-ион (Al(OH)4–), при этом растворимость соединений алюминия растет, что также ведет к высвобождению сорбированного фосфора.
Помимо pH, важно учитывать и другие условия. Как было отмечено выше, гидроксид алюминия наилучшим образом связывает неорганические формы фосфора, поэтому кажется логичным его применение сразу после схода льда, до весеннего максимума развития фитопланктона, активно его потребляющего. Однако температурные условия оказывают большое влияние на реакционную способность алюминия. При низкой температуре хлопьеобразование значительно замедляется, в воде появляется Al(OH)2+ – токсичное соединение для гидробионтов.
Другая важная причина, по которой не следует добавлять соли алюминия ранней весной – высокое содержание минерального фосфора в водоеме и как следствие – возможность полного расходования в реакциях с ним. Первоочередная цель внесения алюминия – блокирование внутреннего поступления фосфора из донных отложений, а не устранение его из водной толщи. Кроме того, в этот сезон года характерны высокие скорости ветра, вызывающие сильное волнение на поверхности водоема. Это может оказать влияние, как на практическую реализацию процедуры, так и на неравномерное распределение вносимых веществ по акватории. Помимо этого стоит учитывать, что кремний – хороший блокатор токсичных форм алюминия, может отсутствовать, из-за потребления диатомовыми водорослями в весеннем пике своего развития.
Таким образом, летнее внесение, непосредственно перед «цветением» синезеленых водорослей, представляется наиболее оптимальным. Также подходящим вариантом является проведение мероприятий ранней осенью, в конце вегетационного цикла (Cooke, 2005). Можно рекомендовать постепенное внесение солей алюминия небольшими порциями, т.к. единовременное добавление большой дозы будет менее эффективным.
Стоит учитывать и другой биологический фактор, влияющий на эффективность удерживания фосфора. Так, например, можно отметить важную
роль бентосной фауны, способной перераспределять соединения алюминия в верхних слоях донных отложений за счет биотурбации, кроме того, рытье ходов в осадках приводит к усилению высвобождения фосфора из более глубоких слоев, где алюминий отсутствует.
Соединения железа и кальция также могут быть использованы для осаждения фосфора. Их применение не вызывает таких проблем, как снижение pH и образование токсичных соединений.
Неорганическое железо может присутствовать в водоеме в окисленной (Fe3+) и восстановленной (Fe2+) формах, в зависимости от окислительно-восстановительного потенциала и pH среды. При этом изменения в редокс-потенциале железа в донных отложениях оказывают существенное влияние на цикл фосфора. В условиях весеннего и осеннего перемешивания водных масс в озере, создаются окислительные условия, и как следствие, железо находится в окисной форме:
Fe2+ + 1/4O2 + 2OH- + 1/2H2O = Fe(OH)3 v
Гидроксид железа, осаждаясь, сорбирует фосфор из водной толщи и образует своеобразные окисленные микрозоны на поверхности донных отложений. В них он удерживает фосфор и препятствует его обратному поступлению в воду.
При наличии температурной стратификации, слой гиполимниона оказывается устойчиво изолированным на период от нескольких дней до нескольких недель (полимиктические озера) или же до нескольких месяцев (димиктические озера). Без фотосинтеза и естественной аэрации (за счет перемешивания), величина pH и особенно содержание растворенного кислорода падают. В случае снижения концентрации ниже 1 мг/л, происходит исчезновение окисленных микрозон, и микроорганизмы начинают использовать железо в качестве альтернативного акцептора электронов. В восстановленной форме железо хорошо растворимо, вследствие чего
начинается высвобождение связанного с ним фосфора. Подобное может происходить и в мелких эвтрофных водоемах, в короткие периоды температурной стабильности, здесь главным фактором будет ветровое воздействие. Кроме того, можно выделить и суточную динамику этого процесса, когда в литоральной зоне водоема фосфор связывается в дневное время и высвобождается ночью. Микроорганизмы также и напрямую влияют на содержание фосфора в воде, активно участвуя в процессах минерализации органических веществ.
Можно отметить, что, несмотря на постоянные бескислородные условия в димиктических стратифицированных водоемах, амплитуда поступления фосфора из донных отложений будет все же больше в мелководных водоемах, без температурной стратификации, и связана она сильнее с трофическим статусом, нежели с глубиной (Cooke, 2005). Кроме этого, подчеркивается, что литоральная зона водоема может являться более мощным внутренним источником биогенов, нежели его профундальная часть.
В максимальной степени окисления находится окисное железо (Fe3+), что может дать основание предположить, что соли именно этой формы оптимальны для удаления фосфора из воды. Однако, несмотря на это, предпочтительным является использование именно солей закисного железа, т.к. применение FeCl2 обладает некоторыми преимуществами по сравнению с FeCl3. Это и замедленное хлопьеобразование и как следствие более продолжительное нахождение в водной толще, и менее заметное влияние на буферную емкость водоема, т.к. при том же количестве железа в водоем попадает на 1/3 меньше анионов хлора.
Важным фактором является также процесс сульфатредукции и связанное с ним образование нерастворимого сульфида железа (FeS). Это ведет к устранению этого металла и делает его недоступным для процессов инактивации фосфора (Cooke, 2005).
Зависимость реакций фосфора с железом от редокс-потенциала и величины pH дает основание говорить о хороших результатах особенно при
использовании дополнительных мер для поддержания окислительных условий. К таким мероприятиям можно отнести аэрирование и искусственную дестратификацию, которые будут рассмотрены далее.
Соединения кальция также влияют на концентрацию фосфора. Гидроксид и карбонат кальция (кальцит) – основные из них. Их использование представляется более безопасным, нежели применение металлов (Al и Fe) (Hupfer et al., 2000). Они могут подаваться в водоем извне или же образовываться автохтонно в ходе протекания процессов фотосинтеза:
Ca(HCO3)2 = CaCO3 + H2O + CO2
При этом происходит поглощение углекислого газа, величина pH растет и CaCO3 начинает выпадать в осадок. Кальцит особенно хорошо сорбирует фосфор из воды при pH>9. При более высоком pH, достатке кальция и фосфора, могут образовываться гидроксиапатиты:
10CaCO3 + 6HPO42– + 2H2O = Ca10(PO4)6(OH)2 + 10HCO3–
Гидроксиапатиты, в отличие от гидроксида железа или алюминия, обладают наименьшей растворимостью при pH>9,5, и наоборот, растворимость кальцита и гидроксиапатита значительно возрастает с ростом концентрации CO2 и падением pH. Последнее особенно характерно для слоя гиполимниона. Таким образом, успешное использование данного связывающего реагента, так же как и железа, сопряжено с применением дополнительных мер, например, подщелачиванием придонных слоев воды (Cooke, 2005). Образованием апатитов, также объясняется хорошие удерживающие свойства кальция непосредственно в донных отложениях.
Соединения алюминия, железа и кальция – вещества, хорошо зарекомендовавшие себя в процессах водоочистки, однако у всех них есть свои недостатки, в связи с чем, идет постоянный поиск новых соединений. Такими
новыми реагентами для удаления фосфора из водной толщи стали соединения на основе глинистых минералов. К ним относятся бентонитовая глина и модифицированные препараты на ее основе (Robb et al., 2003), например, PHOSLOCK™ – бентонит, обогащенный лантаном (рис. 2.1.7, 2.1.8).
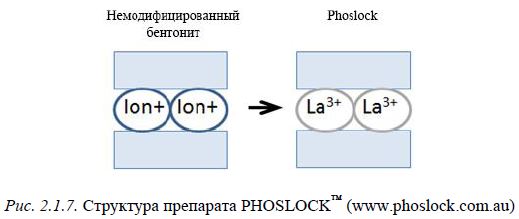
Рис. 2.1.7. Структура препарата PHOSLOCK™ (www.phoslock.com.au)
Высокая сорбционная емкость к фосфору и нетоксичность для гидробионтов, вместе с низкой стоимостью по сравнению с традиционными реагентами, делает использование таких веществ особенно перспективным. Доза внесения PHOSLOCK™ подбирается индивидуально для каждого водоема, как правило, она близка к соотношению 100:1 – 100 грамм препарата на 1 грамм биодоступного фосфора. Стоимость подобной очистки составляет около 250 тыс. руб. на гектар акватории (при расходе 2,5 тонны препарата на гектар).
Также инновационным подходом для целей восстановления можно считать применение магнитных нано- и микрочастиц на основе железа и магнетита, с их последующей сепарацией в магнитном поле, данный метод в настоящее время пока находится в стадии разработки.
Инактивация фосфора непосредственно в водоеме – успешно и широко применяемое технологическое решение для борьбы с эвтрофированием в стратифицированных и нестратифицированных озерах с 1968 г., этот метод дает надежный, но, к сожалению, недолговременный результат. Без дополнительных мероприятий дефицит фосфора быстро восполняется из внешних и внутренних источников.

Рис. 2.1.8. Внесение препарата PHOSLOCK™ для борьбы с синезеленым цветением на водоеме, используемом для питьевого водоснабжения (www.aquatechnex.wordpress.com)
Реагентная очистка (соединения алюминия, железа, кальция) в России не используется, но успешно и широко применяется в зарубежной практике как один из основных методов технологического решения для борьбы с эвтрофированием в озерах.
Вопросы для самоконтроля:
1. Перечислите основные группы фосфора в водоемах, способы их обнаружения. Наиболее важная группа фосфора, с точки зрения применения восстановительных процедур.
2. Снижение реакционной способности фосфора в водоеме. Принципы метода, варианты осуществления, применяемые реагенты (соли алюминия, железа, кальция), определение дозы внесения.
3. Особенности использования солей алюминия для процедур восстановления. Преимущества, происходящие процессы, важные факторы, возможные отрицательные последствия. Определение времени внесения
реагентных добавок, причины выбора, последствия несвоевременного внесения.
4. Применение солей железа для процедур инактивации фосфора. Преимущества, метода, происходящие процессы, важные факторы, возможные отрицательные последствия для водных экосистем.
5. Реагентная очистка водоема при помощи солей кальция. Иннактивация фосфора с использованием инновационных разработок (бентонитовая глина и модифицированные препараты на ее основе). Преимущества метода.









